又称免疫印迹(immunoblotting)具有 SDS-PAGE 的高分辨力和固相免疫测定的高特异性和敏感性,现已成为蛋白分析的一种常规技术。免疫印迹常用于鉴定某种蛋白,并能对蛋白进行定性和半定量分析。结合化学发光检测,可以同时比较多个样品同种蛋白的表达量差异。
一、基本原理
1. 核心目的:通过抗体与目标蛋白的特异性结合,对样本中的特定蛋白进行定性和半定量分析。
2. 关键步骤:
- 电泳分离:利用SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)按分子量大小分离蛋白质。
- 转膜:将分离的蛋白质从凝胶转移到固相膜(如PVDF或硝酸纤维素膜)上,便于后续抗体处理。
- 免疫检测:通过一抗识别目标蛋白,二抗(偶联酶或荧光染料)放大信号,最终显色或发光检测。
二、实验流程
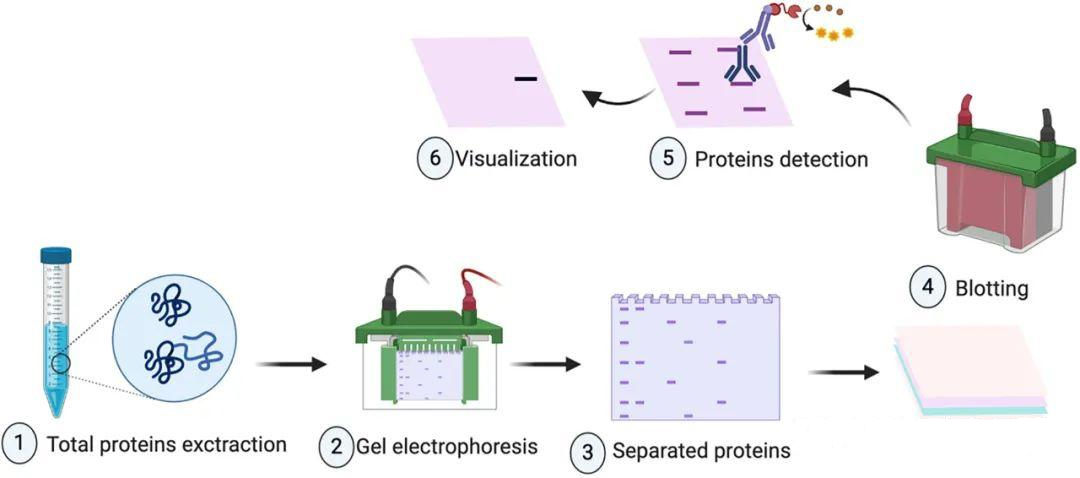
1. 样本制备:
- 裂解细胞或组织,提取总蛋白。
- 使用BCA或Bradford法测定蛋白浓度,确保上样量一致。
2. SDS-PAGE电泳:
- 蛋白样品与SDS结合(带负电),在凝胶中依分子量迁移。
- 小分子量蛋白迁移更快,靠近凝胶底部。
3. 转膜(Blotting):
- 湿转或半干转法将蛋白从凝胶转移到膜上。
- 转膜效率可通过预染Marker或丽春红染色验证。
4. 封闭(Blocking):
- 用脱脂牛奶或BSA封闭膜上的非特异性结合位点,减少背景信号。
5. 抗体孵育:
- 一抗孵育:与目标蛋白特异性结合(通常4°C过夜)。
- 二抗孵育:偶联HRP(辣根过氧化物酶)或AP(碱性磷酸酶)的二抗与一抗结合(室温1-2小时)。
6. 信号检测:
- 化学发光法(常用):HRP催化底物(如ECL)发光,X光片或成像系统捕获信号。
- 显色法:底物(如DAB)产生可见沉淀,但灵敏度较低。
三、关键应用
1. 蛋白表达分析:比较不同样本(如疾病vs正常组织)中目标蛋白的表达差异。
2. 翻译后修饰研究:检测磷酸化、泛素化等修饰(需使用修饰特异性抗体)。
3. 抗体验证:确认抗体的特异性或检测重组蛋白表达。
4. 分子量测定:通过与Marker对比,估算目标蛋白大小。
四、注意事项与常见问题
1. 优化条件:
- 抗体浓度、封闭剂选择、洗涤时间需优化以减少非特异性信号。
- 转膜时间/电流影响大分子量蛋白的转移效率。
2. 内参(Loading Control):
- 使用β-actin、GAPDH等管家蛋白确保上样量一致。
3. 常见问题:
- 高背景:封闭不充分或抗体浓度过高。
- 无信号:抗体失效或转膜失败。
- 非特异条带:抗体交叉反应或样本降解。
Western blotting因其可靠性和广泛适用性,至今仍是蛋白质研究的基础技术,尤其在疾病机制、药物靶点验证等领域不可或缺。




