1.概述
荧光定量PCR(Quantitative Real-time PCR,qPCR)是一种高灵敏度、高特异性的核酸定量技术,广泛应用于mRNA表达水平的检测。该技术通过在PCR反应体系中加入荧光标记物,实时监测扩增产物的积累,从而实现对起始模板的定量分析。
2. 技术原理
2.1 基本流程
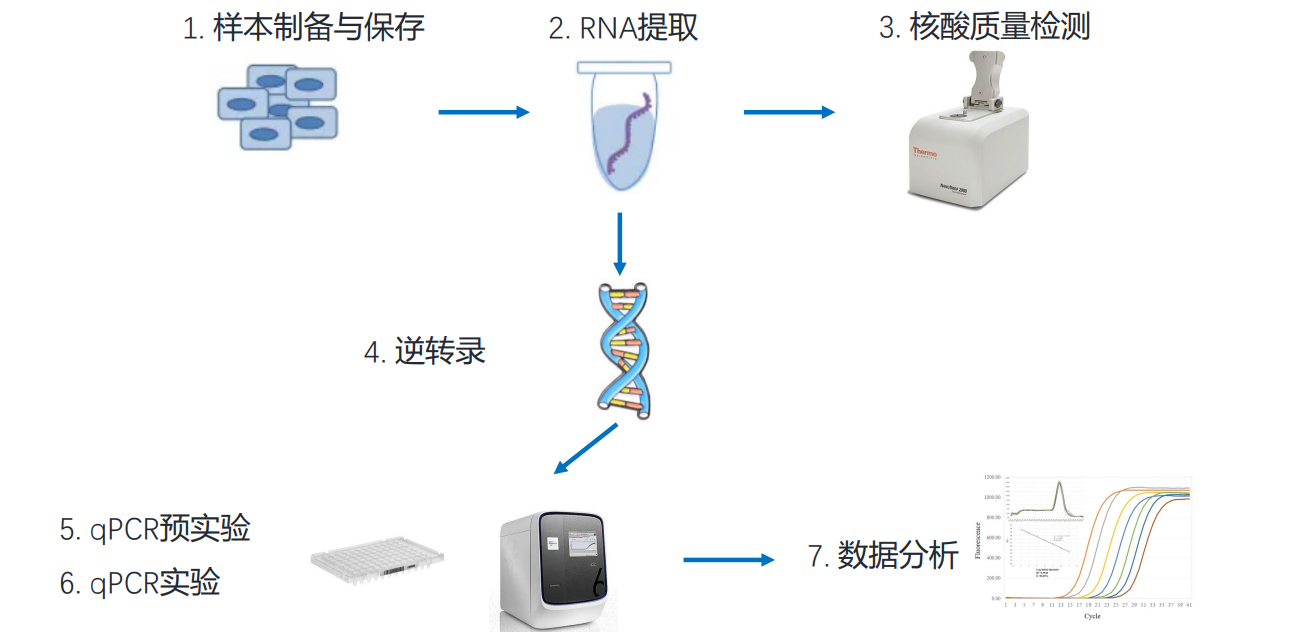
2.2 荧光检测机制
目前常用的荧光检测方法主要有两种:
2.2.1 非特异性荧光染料法(如SYBR Green I)
- 原理:SYBR Green I是一种能与双链DNA小沟结合的荧光染料
- 特点:
- 结合后荧光信号显著增强
- 成本低,使用简便
- 需配合熔解曲线分析确认扩增特异性
2.2.2 特异性荧光探针法(如TaqMan探针)
- 原理:
- 探针5'端标记报告荧光基团,3'端标记淬灭基团
- Taq DNA聚合酶的5'→3'外切酶活性水解探针,释放荧光
- 特点:
- 特异性更高
- 可进行多重PCR
- 成本较高
2.3 定量原理
荧光定量PCR通过监测荧光信号达到设定阈值时的循环数(Ct值)进行定量:
- Ct值:每个反应管内的荧光信号达到设定阈值时所经历的循环数
- 标准曲线法:使用已知浓度的标准品建立Ct值与起始模板量的对数关系
- 相对定量法(2-ΔΔCt法):
- 比较处理组与对照组的靶基因表达差异
- 需使用内参基因进行校正
3. 实验关键环节
3.1 RNA提取与质量评估
- 提取方法:Trizol法、柱膜法等
- 质量评估指标:
- A260/A280比值:1.8-2.0
- A260/A230比值:>2.0
- RNA完整性:电泳或RIN值评估
3.2 逆转录反应
- 逆转录酶选择:M-MLV、AMV等
- 引物设计:
- Oligo(dT):适用于polyA+ mRNA
- 随机引物:适用于所有RNA,包括非polyA RNA
- 基因特异性引物:特异性最高
3.3 引物与探针设计
- 基本原则:
- 长度:18-22bp
- Tm值:58-60℃
- GC含量:40-60%
- 避免二级结构和引物二聚体
- 验证要求:
- 扩增效率:90-110%
- 特异性:单一峰熔解曲线或单一扩增条带
4. 数据分析方法
4.1 绝对定量
- 使用标准品建立标准曲线
- 计算未知样品中的绝对拷贝数
4.2 相对定量
常用2-ΔΔCt法:
1. 计算ΔCt = Ct(靶基因) - Ct(内参基因)
2. 计算ΔΔCt = ΔCt(实验组) - ΔCt(对照组)
3. 相对表达量 = 2-ΔΔCt
4.3 数据标准化
- 内参基因选择:GAPDH、β-actin、18S rRNA等
- 多内参基因策略可提高可靠性
5. 技术优势
1. 高灵敏度:可检测单拷贝基因
2. 宽动态范围:可达7-8个数量级
3. 高特异性:特别是探针法
4. 高通量:可同时检测多个样本/基因
5. 无PCR后处理:闭管操作减少污染
6. 主要应用领域
6.1 基础研究
- 基因表达谱分析
- 信号通路研究
- 转录调控机制研究
- 差异表达基因验证
6.2 医学应用
- 疾病诊断:
- 肿瘤标志物检测
- 病原体核酸检测
- 遗传病诊断
- 预后评估:
- 肿瘤分子分型
- 治疗靶点表达分析
- 药物研发:
- 药物靶点验证
- 药效评价
- 毒性评估
6.3 农业应用
- 转基因作物检测
- 病原体检测
- 性状相关基因表达分析
6.4 环境监测
- 环境微生物检测
- 生物标志物分析
7. 技术发展
7.1 数字PCR(dPCR)
- 绝对定量,不依赖标准曲线
- 更高灵敏度和准确性
- 适合低丰度样本和稀有突变检测
7.2 多重qPCR
- 同时检测多个靶标
- 节省样本和试剂
- 需优化引物探针组合
7.3 高通量qPCR
- 384孔板或更高通量
- 自动化操作
- 大规模表达谱分析
8. 展望
荧光定量PCR技术作为基因表达分析的金标准,未来发展趋势包括:
- 更高通量的微流控系统
- 更便捷的现场检测设备
- 与测序技术的联合应用
- 人工智能辅助的数据分析
随着技术的不断革新,荧光定量PCR将在生命科学研究和临床诊断中发挥更加重要的作用。




